(Wankat, 3 ed. – Cap. 13 – D25) Deseja-se remover ácido acético da água utilizando éter isopropílico como solvente. A operação é realizada a e . Os dados de equilíbrio nestas condições estão presentes na tabela abaixo. A alimentação é composta de em massa de ácido acético e em massa de água. A vazão da alimentação é de . Um sistema em contra-corrente é utilizado. O solvente é alimentado puro. Deseja-se uma corrente de extrato com de ácido acético e um rafinado com de ácido acético.
- Qual a quantidade de solvente necessária?
- Quantos estágios de equilíbrio são necessários?
Passo 1
Heyy, tudo bem? Nessa questão nós vamos analisar um processo de extração em um sistema contra-corrente onde esquematicamente nós temos:
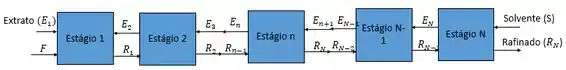
A partir disso vamos calcular a quantidade de solvente necessária e o número de estágios de equilíbrio. Então vamos lá!
Passo 2
Para encontrar a quantidade de solvente necessária vamos precisar realizar um balanço de massa global no sistema. Ou seja,
O enunciado nos forneceu os seguintes dados:
Além disso, como nos foi dito que deseja-se uma corrente de extrato com de ácido acético e um rafinado com de ácido acético. Temos que,
Substituindo isso na expressão do balanço temos,
Logo, a quantidade de solvente necessária é,
Passo 3
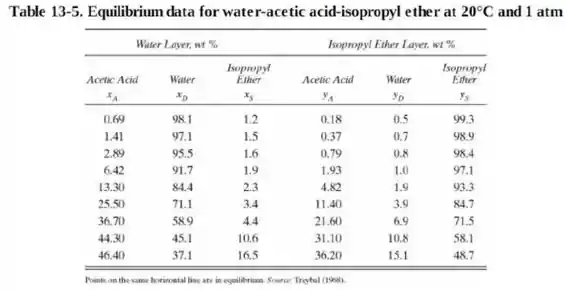
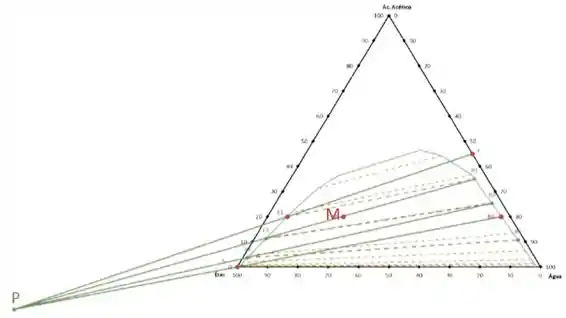
Plotando um gráfico com os dados da tabela 13.5:
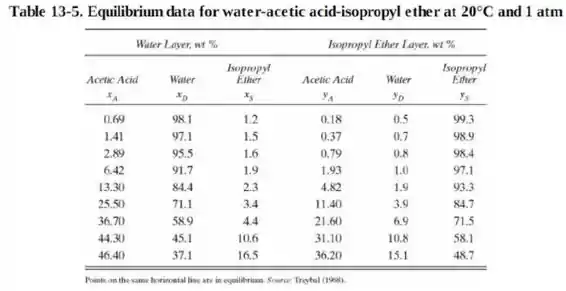
Concluímos que serão necessários estágios. Porém como não se pode ter número quebrado de estágios iremos considerar como estágios.
Resposta
a)
b)