- Esquematize a curva de titulação para a titulação de 5,00 mL de com , identificando os pontos inicial e final, os pontos estequiométricos e cada um dos pontos médios.
- Qual volume de KOH foi adicionado em cada ponto estequiométrico?
- Determine o pH em cada ponto estequiométrico. Para , e .
Passo 1
Legal galera, no momento inicial nós temos somente o ácido em solução aquosa, então o que acontece neste caso?
![]()
Sabemos que para este caso:
Achando a concentração de cátions, usando esta constante:
No equilíbrio teremos:
Jogando na fórmula:
Resolvemos a equação de segundo grau:
Agora nós conseguimos calcular o pH no ponto inicial, certo?
Então:
Então, no ponto inicial nós teremos um pH de 2,3 e um volume de KOH equivalente a 0 mL.
Passo 2
O próximo ponto é o primeiro ponto médio. Neste ponto, o KOH reage completamente com o ácido para convertê-lo na sua forma monoprótica.
Para acha-lo nós precisamos olhar a relação entre e :
Como:
Então:
Para ente primeiro ponto médio teremos:
Passo 3
Agora nós precisamos achar o primeiro ponto estequiométrico, onde o número de mols do ácido e da base são iguais.
E para acha-lo nós precisamos achar o número de mols do ácido:
Substituindo:
Neste ponto temos:
Com isto nós conseguimos achar qual o volume da base foi usado
Então, nós temos ambos, ácido e base, em quantidades iguais na solução. Como a base adicionada reagiu com todo o , agora nós só teremos .
Neste caso nós podemos calcular o pH como a média dos pKa’s do ácido, ignorando a terceira dissociação:
Então, no primeiro ponto estequiométrico nós teremos pH de 4,5 quando adicionamos 5 mL da base.
Passo 4
No segundo ponto médio nós teremos a mesma situação que o Passo 2, então:
No segundo ponto estequiométrico nós teremos :
Como vimos anteriormente, certo?
E quanto aos mols da base?
Agora é só calcular o volume:
Como nós já tínhamos adicionado 5 mL, o volume total será de 10 mL, certo?
Aqui, novamente nós teremos concentrações iguais do ácido e da base na solução, e restará somente na solução.
E para achar sua concentração nós podemos usar a concentração da base, já que:
Sendo assim:
Lembrando que:
Então:
Vamos guardar esta informação!
Passo 5
Para achar o pH neste segundo ponto estequiométrico nós teremos que considerar este equilíbrio:
![]()
A constante no equilíbrio será:
Lembrando que:
Então:
Construindo a tabela das concentrações no equilíbrio:

Lembrando que:
Substituindo:
Resolvendo a equação de segundo grau:
Podemos achar com isso o pOH:
Substituindo:
Mas queremos o pH, certo?
Então no segundo ponto estequiométrico teremos um pH de 9,3 quando o volume da base é de 10 mL
Passo 6
Resumindo:
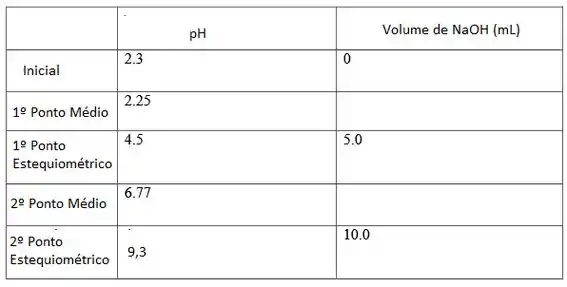
Agora é só desenhar:
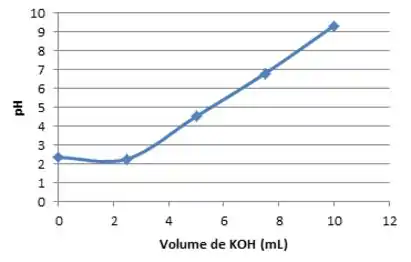
Ufaaa ! Essa foi pesada, não foi?
Resposta
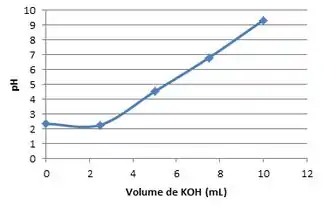
- e c)